細胞医薬開発
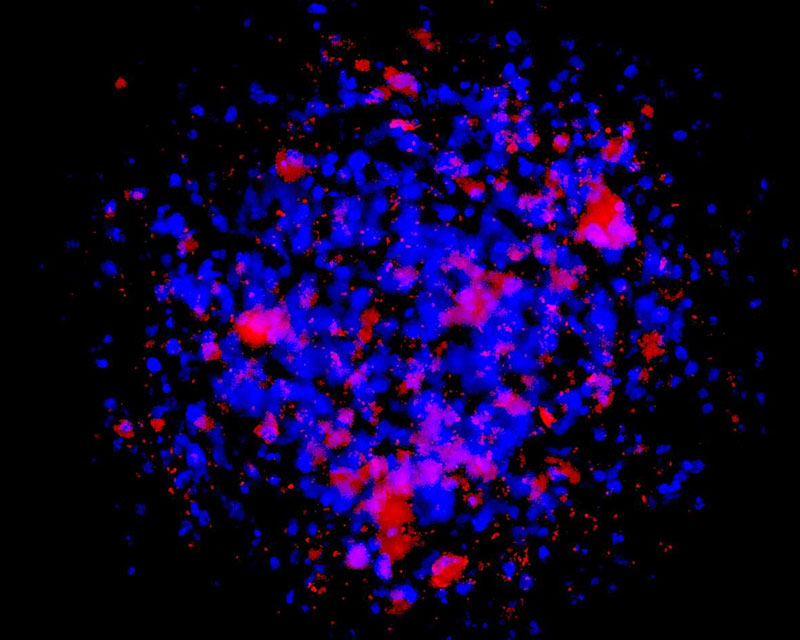
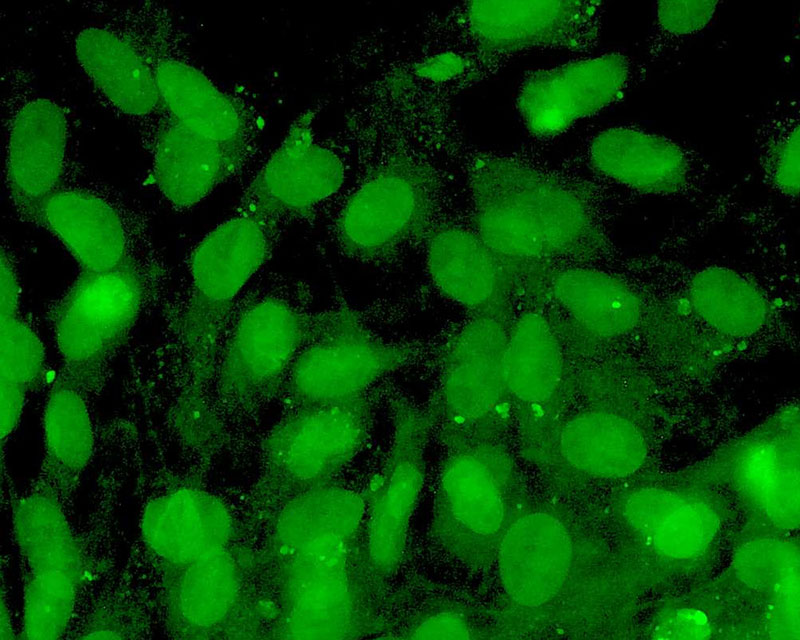
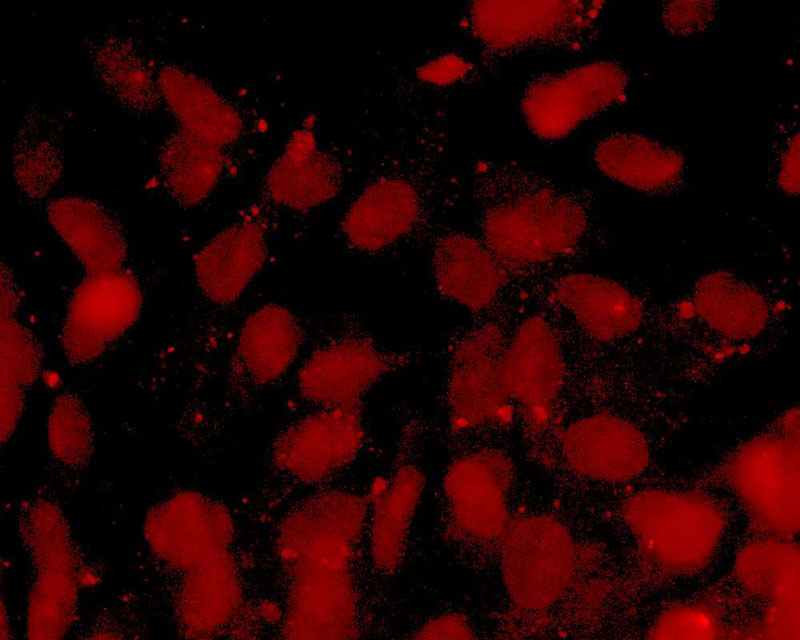
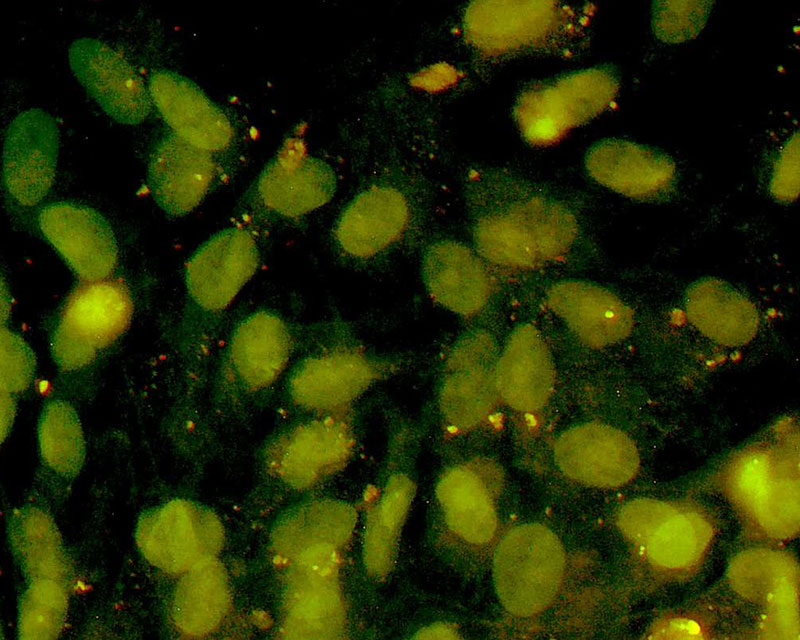
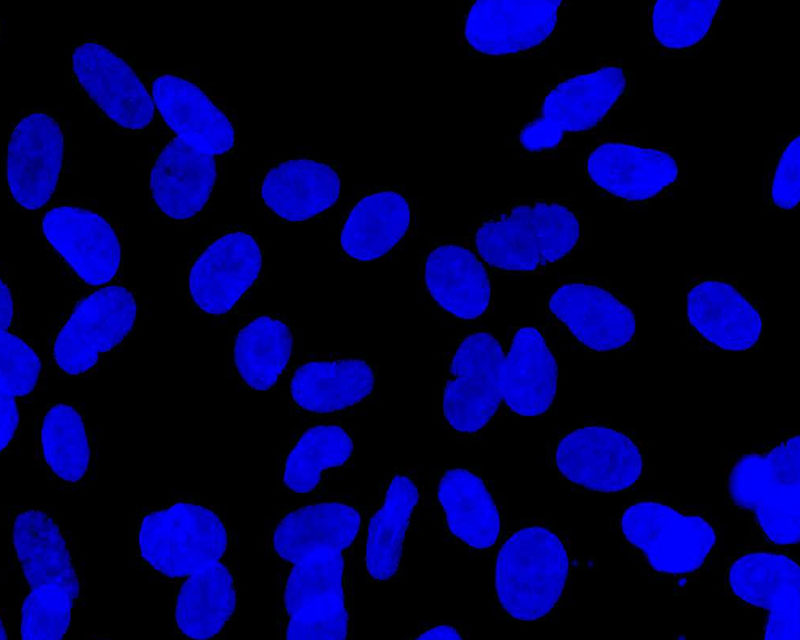
当社は線維芽細胞などの体細胞に新規開発CE-ペプチドを作用させることで、他の臓器/組織細胞に直接分化させる新たな手法(特許出願中)を開発しました。
この技術は、iPS細胞作製のように遺伝子導入法を用いず、さらには多能性幹細胞作製ステップを踏まないため、ダイレクトリプログラミング(Direct Cell Reprogramming)あるいはトランスディファレンシエーション(Transdifferentiation)と呼ばれています。
私たちは、この新技術で患者さん自身の細胞から各種臓器の前駆細胞を作製し、その細胞そのものを医薬品として投与し、ケガや疾患により傷ついた臓器機能を自分自身の細胞で修復する治療に応用したい考えです。
今後の事業化に向けて、大学・医療機関との共同研究で医学的POCの確立を進めるとともに、事業会社との協業体制で医療実装を進めたい考えです。
がん免疫細胞療法
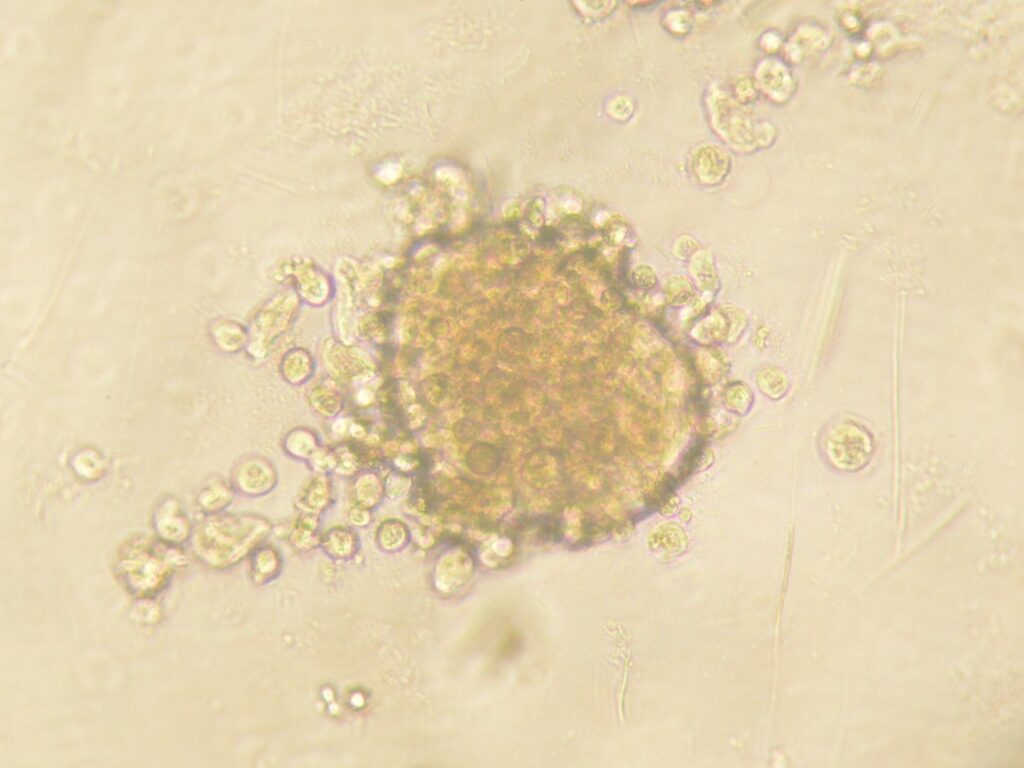

CE-ペプチドとがん幹細胞オルガノイド作製技術を融合し、ネオ抗原(Neoantigen)の探索モデルを作製しています。この技術を活用して、ネオ抗原を標的としたT細胞輸注療法(TIL療法、TCR-T療法)、あるいはがんワクチン療法への応用開発を目指しています。
今後の医療実装に向けて、腫瘍免疫療法に取り組む実地医療機関や研究所、ならびに大学との共同研究で医学的POCの確立を進めるとともに、事業会社との協業体制で取組みたい考えです。